Ce livre blanc repose sur notre savoir-faire en étalonnage de spectrophotomètres, basé sur les exigences des pharmacopées.
 |
Ce livre blanc repose sur notre savoir-faire en étalonnage de spectrophotomètres, basé sur les exigences des pharmacopées. |
Les pharmacopées sont des organismes réglementaires qui définissent les instructions applicables aux procédures et aux instruments d'analyse pour la préparation et la mesure des produits pharmaceutiques. Dans leur documentation, la pharmacopée américaine (USP) et la pharmacopée européenne (Ph. Eur.) stipulent toutes deux les exigences relatives aux spectrophotomètres UV/ Vis et à la vérification de leurs performances, c'est-à-dire à leur étalonnage. Pour aider les clients à s'adapter aux changements des deux pharmacopées, effectifs dès 2020, METTLER TOLEDO a adapté ses accessoires de vérification automatique des performances. Ce document fait la synthèse des révisions relatives à la spectroscopie UV Vis dans les réglementations USP et Ph. Eur., en étudiant en détail leurs conséquences et les solutions disponibles pour garantir la conformité.
Pourquoi est-il important d'étalonner les spectrophotomètres UV/Vis ?
C'est important car les performances de ces instruments influent directement sur la précision et la répétabilité des mesures. Lorsque les mesures UV Vis sont essentielles, en particulier dans le contrôle de la qualité clinique, pharmaceutique et industrielle, il est crucial que l'instrument fonctionne conformément à ses spécifications. Dans les laboratoires travaillant conformément aux réglementations des pharmacopées (p. ex. USP et Ph. Eur.), les performances des instruments doivent être surveillées régulièrement et documentées.
Qu'est-ce que la qualification opérationnelle (QO) des spectrophotomètres ?
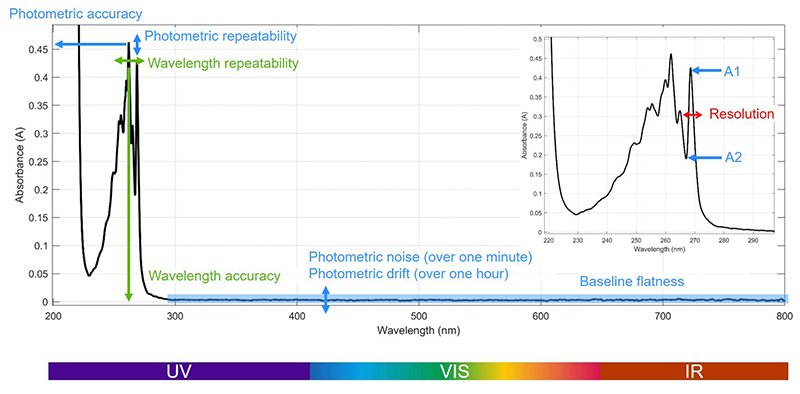
D'après les pharmacopées américaine et européenne, la QO des spectrophotomètres comprend généralement les tests suivants :
exactitude et répétabilité photométriques, linéarité photométrique, lumière diffuse, précision et répétabilité de la longueur d'onde, résolution.
Téléchargez le livre blanc pour connaître les détails des différents paramètres et consultez la rubrique sur l'étalonnage des spectrophotomètres UV/Vis pour savoir comment ils sont mesurés en pratique.
Quelles sont les révisions apportées aux versions précédentes des pharmacopées européenne et américaine ?
Depuis le 1er janvier 2020, la procédure de qualification opérationnelle est soumise aux modifications suivantes :
- Détermination de la linéarité photométrique, dans les deux pharmacopées.
- Dans la dernière version de l'USP, le test de lumière diffuse selon la procédure B, (méthode de longueur d'onde spécifique) est accepté en complément de la procédure A (méthode du ratio solution/filtre). Les deux méthodes sont expliquées dans le chapitre 2.3.4.
- Dans les dernières versions des deux pharmacopées, l'utilisation d'acide nicotinique (niacine) pour la qualification photométrique dans la région UV est autorisée en complément de la méthode au dichromate de potassium (PDC) utilisée jusqu'ici.
- Les deux pharmacopées exigent la qualification des mêmes paramètres optiques. La seule exception est le test de répétabilité photométrique, exigé par l'USP uniquement.